Шта је анода и катода - једноставно објашњење
Електрохемија и галванско полирање
Постоје два главна одсека у електрохемији:
- Галванске ћелије - производња електричне енергије хемијском реакцијом. Ови елементи укључују батерије и акумулаторе. Они се често називају хемијским изворима струје.
- Електролиза - утицај на хемијску реакцију са електричном енергијом, једноставним речима - уз помоћ извора енергије креће реакција.
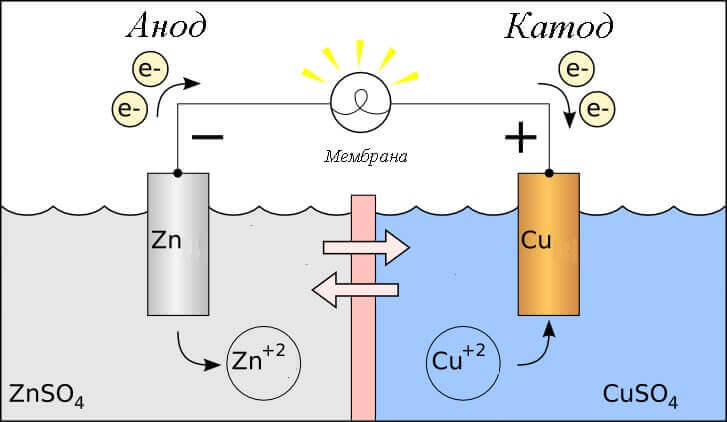
Размотримо редокс реакцију у галванској ћелији, па који се процеси дешавају на њеним електродама?
- Анода - електрода на коју се посматра оксидативна реакцијато је ондаје електроне. Назива се електрода на којој се одвија оксидациона реакција редукционо средство.
- Катода - електрода на којој тече реакција опоравкато је онприхвата електроне. Назива се електрода на којој долази до реакције редукције оксидирајуће средство.
Поставља се питање - где је плус и где је минус батерија? На основу дефиниције галванске ћелије анода даје електроне.
Важно! ГОСТ 15596-82 даје службену дефиницију назива закључака хемијских извора струје, укратко, плус плус на катоди и минус на аноди.
У овом случају се разматра проток електричне струје. дуж проводника спољног круга од оксидант катода до редуктант (анода). Пошто електрони у кругу теку од минус до плус, а електрична струја је обрнуто, тада је катода плус, а анода минус.
Пажња: струја увек тече у аноду!
Или исто у дијаграму:
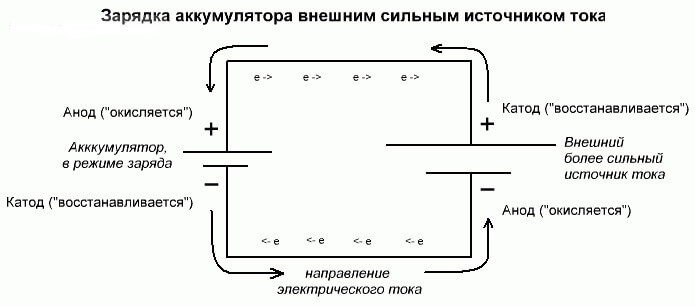
Процес електролизе или пуњења батерије
Ови процеси су слични и обрнути са галванском ћелијом, јер овде не долази од енергије хемијском реакцијом, већ се одвија хемијска реакција из спољног извора електричне енергије.
У овом случају, плус напајање се такође назива катода, а минус анода. Али контакти пуњиве галванске ћелије или електрода електролизера већ ће имати супротна имена, да видимо зашто!
Важно! Када се галванска ћелија испразни, анода је минус, катода је плус, и обрнуто приликом пуњења.
Пошто се струја са позитивног терминала извора напајања доводи до позитивног терминала акумулатора, последњи више не може бити катода.Позивајући се на горе наведено, можемо закључити да у овом случају електроде акумулатора условно мијењају мјеста приликом пуњења.
Затим се кроз електроду напуњене галванске ћелије у коју уђе електрична струја назива анода. Испада да приликом пуњења батерије плус постаје анода, а минус катода.
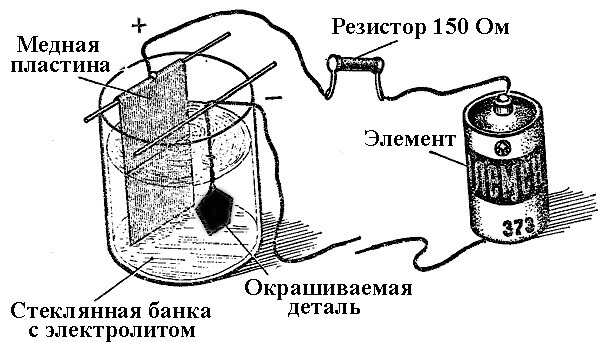
Галванско посуђивање
Поступци таложења метала као резултат хемијске реакције под утицајем електричне струје (током електролизе) називају се галванским инжењерингом. Тако је свет добио сребрни, позлаћени, хромирани или други метални накит и детаље. Овај поступак се користи и за декоративне и за примењене сврхе - за побољшање отпорности на корозију различитих компоненти и склопова механизама.
Принцип рада постројења за галванизацију лежи у употреби солних раствора елемената који ће прекрити део као електролит.
Код галванизирања анода је такође електрода на коју је прикључен позитиван излаз извора енергије, односно катода је у овом случају минус. У овом случају, метал се таложи (редукује) на негативној електроди (реакција редукције). То јест, ако желите да направите позлаћени прстен својим рукама - повежите негативни излаз напајања са њим и ставите га у контејнер са одговарајућим решењем.
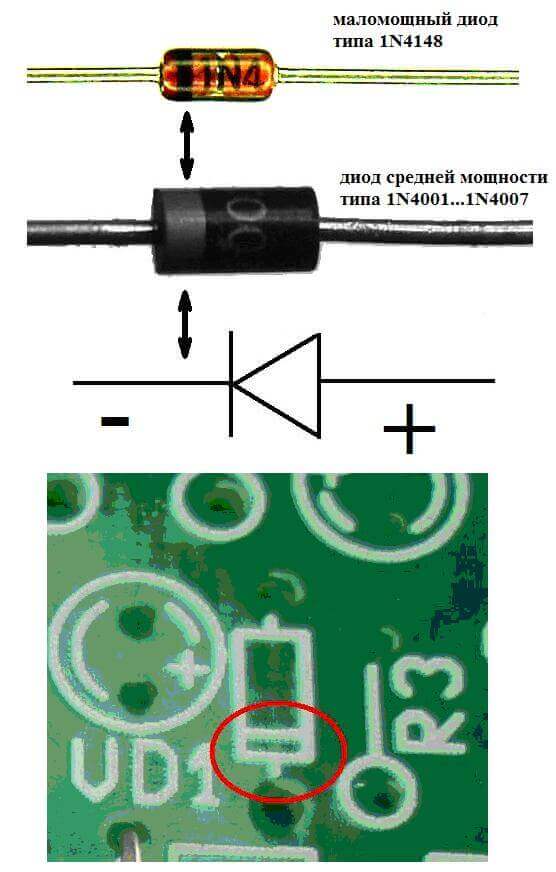
У електроници
Електроде или ножице полуводичких и вакуумских електронских уређаја такође се често називају анода и катода. Размотрите условно графичко означавање полуводичке диоде на дијаграму:
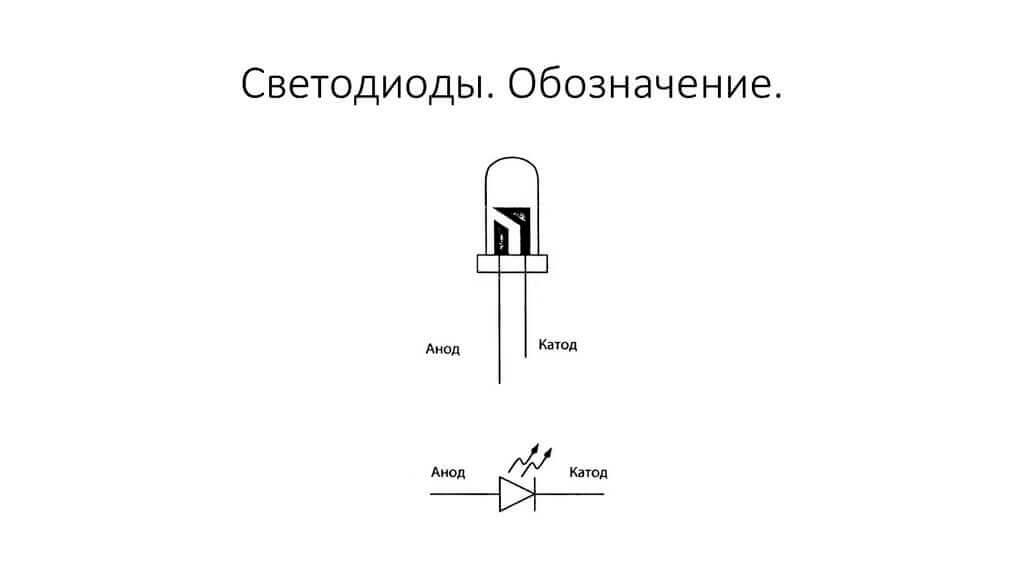
Као што видимо, анода диоде је повезана са плусом батерије. Тако се зове из истог разлога - у овом случају струја се у сваком случају улива на излаз диоде. На стварном елементу на катоди налази се ознака у облику траке или тачке.
ЛЕД је сличан. На 5 мм ЛЕД, унутрашњости су видљиве кроз тиквицу. Половина која је већа је катода.
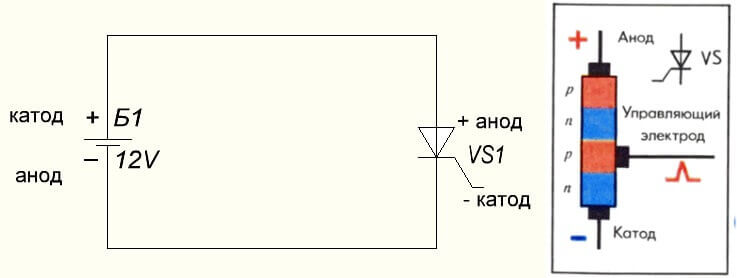
Ситуација је и са тиристором, сврха закључака и „униполарна“ примена ових троножних компоненти чине је контролисаном диодом:
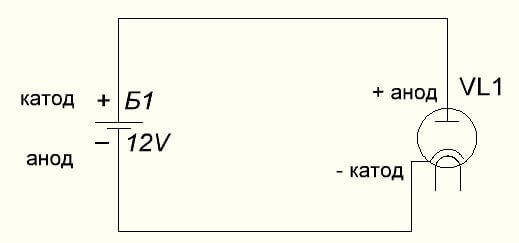
Вакуум диода такође повезује аноду са плусом, а катоду на минус, што је приказано на доњем дијаграму. Иако се приликом примене обрнутог напона називи ових елемената неће променити, упркос протоку електричне струје у супротном смеру, иако безначајно.
Са пасивним елементима као што су кондензатори и отпорници, то није случај. Катода и анода нису изолиране одвојено од отпорника, струја у њему може тећи у било којем смјеру. Можете дати било које име закључцима, у зависности од ситуације и шеме о којој је реч. Конвенционални неполарни кондензатори такође. Рјеђе је ово раздвајање имена контаката посматрано у електролитичким кондензаторима.
Закључак
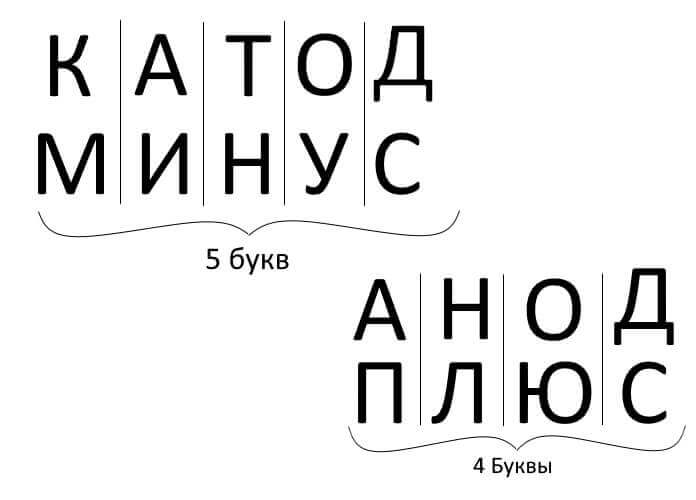
Дакле, да сумирам, одговарајући на питање: како запамтити где је плус, где је минус катоде са анодом? Постоји прикладно мнемолошко правило за електролизу, пуњење батерија, галванизацију и полуводичке уређаје. Ове речи са сличним именима имају исти број слова, као што је приказано у наставку:
У свим тим случајевима струја тече са катоде и струји у аноду.
Не брини вас конфузија: "зашто је катода позитивна на батерију, а када је напуњена постаје негативна?" Запамтите за све елементе електронике, као и електролиторе и за галванизацију - уопште, за све потрошаче енергије анода је излаз повезан са плусом. Разлике се ту завршавају, сада је лакше схватити који је плус и минус између излаза елемената и уређаја.
На крају, препоручујемо вам да погледате користан видео о теми чланка:
Сада знате шта су анода и катода, као и како их довољно брзо запамтити. Надамо се да су вам пружене информације биле корисне и занимљиве!
Сродни материјали: