Anot ve katot nedir - basit bir açıklama
Elektrokimya ve Elektrokaplama
Elektrokimyada iki ana bölüm vardır:
- Galvanik hücreler - kimyasal reaksiyon yoluyla elektrik üretimi. Bu elemanlar pilleri ve akümülatörleri içerir. Bunlara genellikle kimyasal akım kaynakları denir.
- Elektroliz, elektriğin kimyasal reaksiyon üzerindeki etkisidir, basit bir şekilde - bir güç kaynağı kullanılarak bir reaksiyon başlatılır.
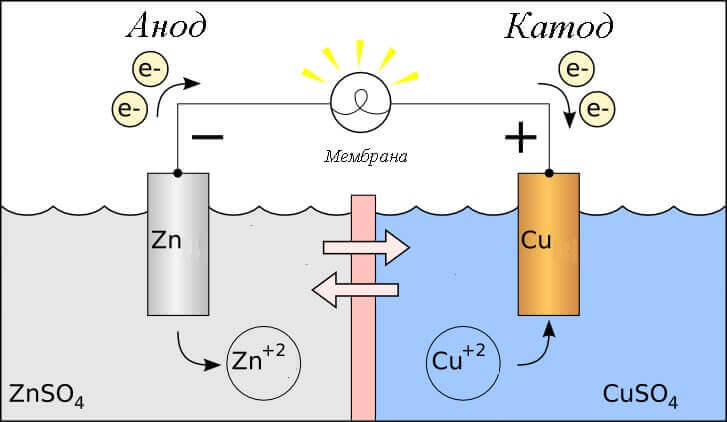
Galvanik bir hücrede redoks reaksiyonunu düşünün, o zaman elektrotlarında hangi işlemler gerçekleşir?
- Anot - gözlemlenen elektrot oksidatif reaksiyonyani oelektron verir. Oksidasyon reaksiyonunun meydana geldiği elektrot denir indirgen madde.
- Katot - üzerinde akan elektrot iyileşme reaksiyonuyani oelektronları kabul eder. İndirgeme reaksiyonunun meydana geldiği elektrot denir oksitleyici ajan.
Bu şu soruyu akla getiriyor - artı nerede ve pilin eksi nerede? Galvanik hücre tanımına göre anot elektron verir.
Önemli! GOST 15596-82 kısaca, katot üzerinde ve anot üzerinde eksi olarak kimyasal akım kaynaklarının sonuçlarının adlarının resmi bir tanımını verir.
Bu durumda, elektrik akımı akışı dikkate alınır. harici devrenin iletkeni boyunca itibaren oksitleyici (katot) için indirgeyici (anot). Devredeki elektronlar eksi artı artı ve elektrik akımı tersi olduğu için, katot bir artı ve anot eksi.
Dikkat: akım her zaman anodun içine akar!
Veya şemadaki gibi:
Akü elektrolizi veya şarj işlemi
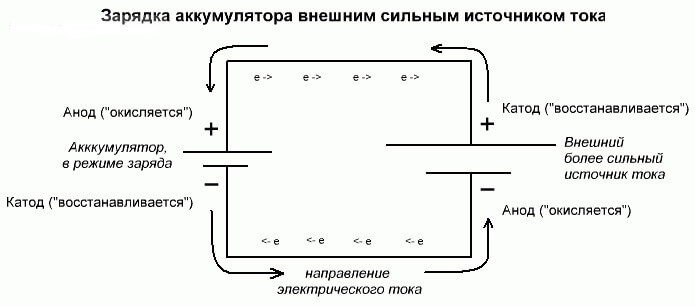
Bu süreçler galvanik hücreye benzer ve tersdir, çünkü burada enerji kimyasal bir reaksiyondan gelmez, aksine - harici bir elektrik kaynağı nedeniyle kimyasal bir reaksiyon meydana gelir.
Bu durumda, artı güç kaynağına katot ve eksi anot da denir. Ancak şarj edilebilir galvanik hücrenin veya elektrolizörün elektrotlarının temasları zaten zıt isimlere sahip olacak, neden görelim!
Önemli! Bir galvanik hücre boşaltıldığında, anot eksi, katot artıdır ve şarj sırasında bunun tersi olur.
Güç kaynağının pozitif terminalinden gelen akım, pilin pozitif terminaline sağlandığından, ikincisi artık bir katot olamaz.Yukarıdakilere istinaden, bu durumda pilin elektrotlarının şarj sırasında şartlı olarak yer değiştirdiği sonucuna varabiliriz.
Daha sonra, içine bir elektrik akımının aktığı yüklü bir galvanik hücrenin elektrotuna anot denir. Pili şarj ederken artıların anot ve eksi katot haline geldiği ortaya çıkıyor.
Elektro
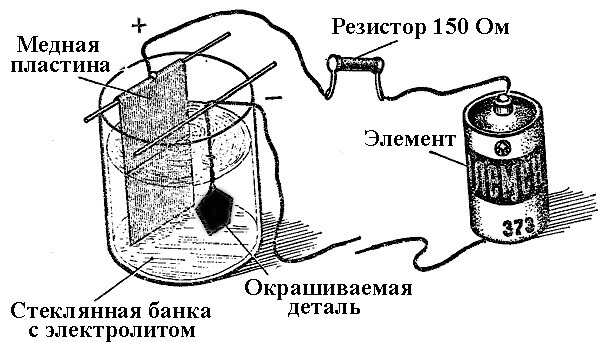
Bir elektrik akımının (elektroliz sırasında) etkisi altında kimyasal reaksiyon sonucu metal birikim süreçlerine galvanik mühendislik denir. Böylece, dünya gümüş kaplama, yaldızlı, krom kaplama veya diğer metal kaplama takılar ve detaylar aldı. Bu işlem hem dekoratif hem de uygulamalı amaçlar için kullanılır - çeşitli bileşenlerin ve mekanizma montajlarının korozyon direncini arttırmak için.
Elektrokaplama tesislerinin çalışma prensibi, parçayı elektrolit olarak kaplayacak elementlerin tuz çözeltilerinin kullanımında yatmaktadır.
Elektrokaplamada, anot aynı zamanda güç kaynağının pozitif çıkışının bağlı olduğu bir elektrottur, bu durumda katot bir eksi olur. Bu durumda, metal negatif elektrot (indirgeme reaksiyonu) üzerinde biriktirilir (indirgenir). Yani, kendi ellerinizle yaldızlı bir halka yapmak istiyorsanız - güç kaynağının negatif çıkışını ona bağlayın ve uygun çözüm içeren bir kaba yerleştirin.
Elektronikte
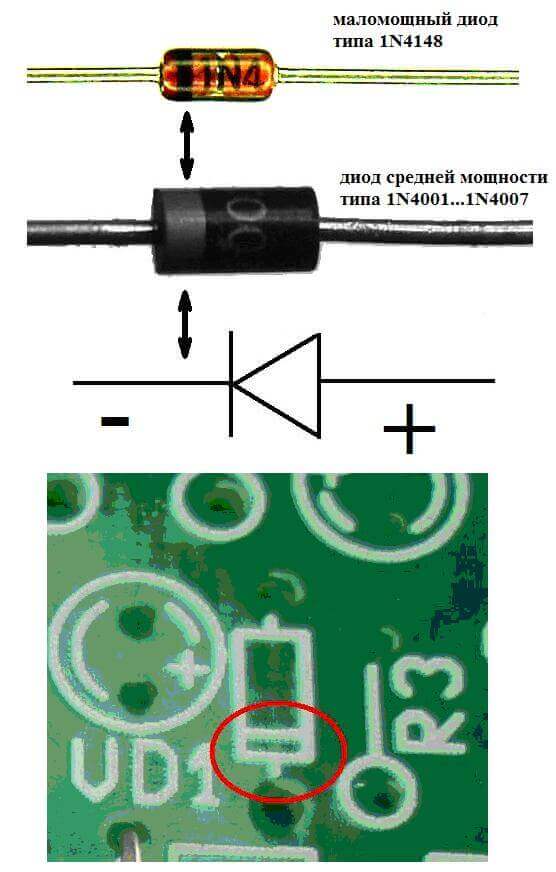
Yarı iletken ve vakumlu elektronik cihazların elektrotları veya bacaklarına genellikle anot ve katot denir. Diyagramda bir yarı iletken diyotun koşullu grafik atamasını düşünün:
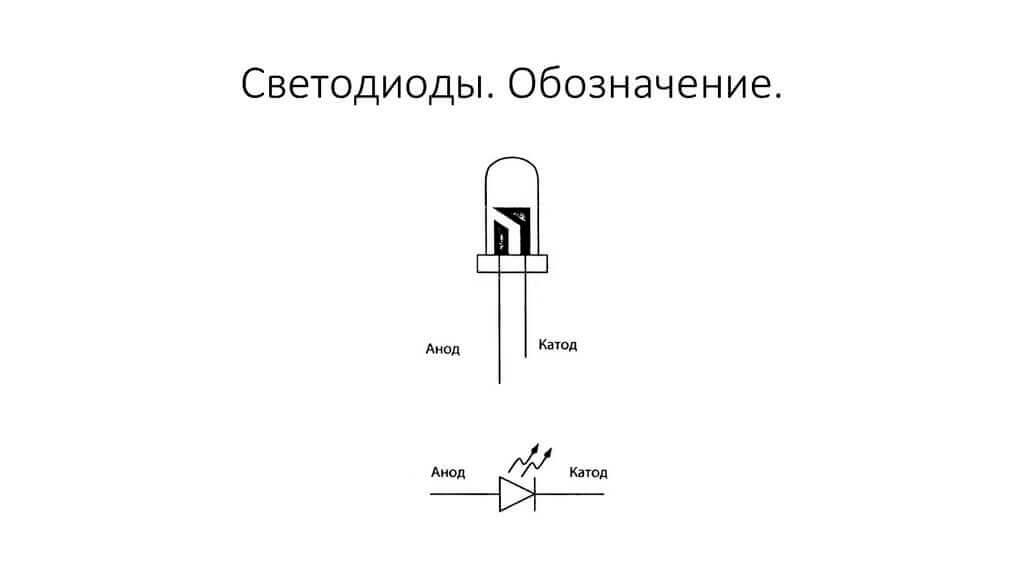
Gördüğümüz gibi, diyotun anodu pilin artısına bağlıdır. Aynı nedenden ötürü denir - bu durumda, akım her durumda diyotun çıkışına akar. Katot üzerindeki gerçek bir elemanda bir şerit veya nokta şeklinde bir işaret vardır.
LED benzer. 5 mm LED'lerde iç kısım şişeden görülebilir. Daha büyük olan yarısı katottur.
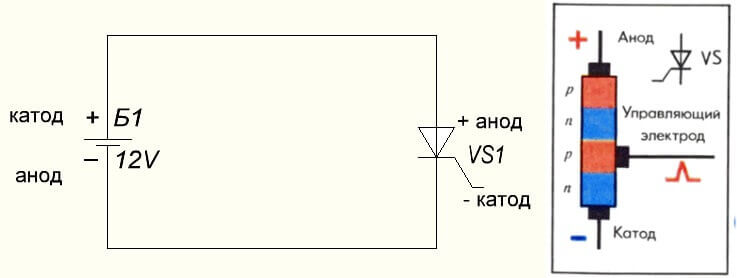
Durum aynı zamanda tristörde, sonuçların amacı ve bu üç ayaklı bileşenlerin “tek kutuplu” uygulaması onu kontrollü bir diyot yapar:
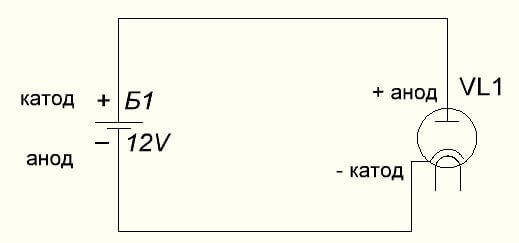
Vakum diyotu ayrıca anotu artıya ve katodu eksi olarak aşağıdaki şemada gösterilmiştir. Ters voltaj uygulanırken, elektrik akımının ters yönde olmasına rağmen, önemsiz de olsa, bu elemanların adları değişmeyecektir.
Kapasitörler ve dirençler gibi pasif elemanlarda durum böyle değildir. Katot ve anot, dirençten ayrı olarak izole edilmez; içindeki akım herhangi bir yönde akabilir. Duruma ve söz konusu şemaya bağlı olarak sonuçlarına herhangi bir isim verebilirsiniz. Geleneksel polar olmayan kapasitörler de. Daha az yaygın olarak, kontak adlarının bu ayrılması elektrolitik kapasitörlerde gözlenir.
Sonuç
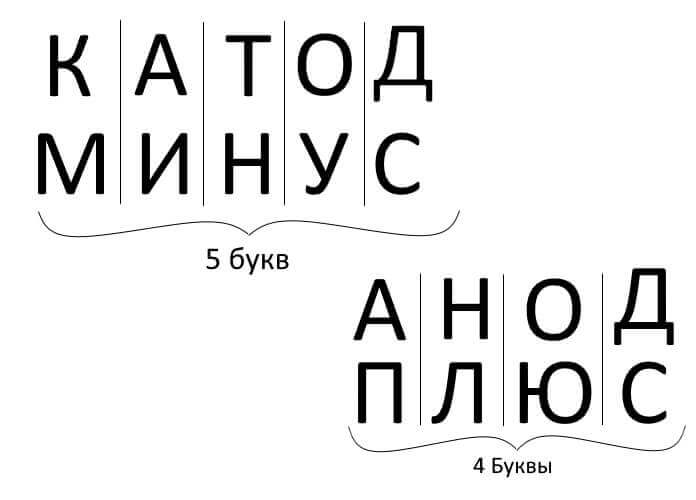
Özetlemek gerekirse, soruyu cevaplamak: artı nerede nerede hatırlanır, anotlu katot eksi nerede? Elektroliz, akü şarjı, elektrokaplama ve yarı iletken cihazlar için uygun bir anımsatıcı kural vardır. Benzer adlara sahip bu kelimeler, aşağıda gösterildiği gibi aynı sayıda harfe sahiptir:
Tüm bu durumlarda, akım katottan akar ve anoda akar.
Karışıklık ile karıştırmayın: “katot neden batarya için pozitif ve şarj olduğunda negatif oluyor?” Elektrolizörlerin yanı sıra elektrolizörlerin yanı sıra elektroniğin tüm elemanları için hatırlayın - genel olarak, tüm enerji tüketicileri için anot, artıya bağlı çıktıdır. Farklılıklar burada sona eriyor, şimdi, elemanların ve cihazların çıkışları arasındaki artı ve eksi'nin ne olduğunu bulmanız daha kolay.
Son olarak, makalenin konusuyla ilgili faydalı bir video izlemenizi öneririz:
Şimdi anot ve katodun ne olduğunu ve bunları yeterince hızlı bir şekilde nasıl hatırlayacağınızı biliyorsunuz. Sağlanan bilgilerin sizin için yararlı ve ilginç olduğunu umuyoruz!
İlgili malzemeler: