Hva er anoden og katoden - en enkel forklaring
Elektrokjemi og galvanisering
Det er to hoveddeler innen elektrokjemi:
- Galvaniske celler - produksjon av elektrisitet gjennom en kjemisk reaksjon. Disse elementene inkluderer batterier og akkumulatorer. De kalles ofte kjemiske strømkilder.
- Elektrolyse er effekten av elektrisitet på en kjemisk reaksjon, med enkle ord - en reaksjon startes ved bruk av en strømkilde.
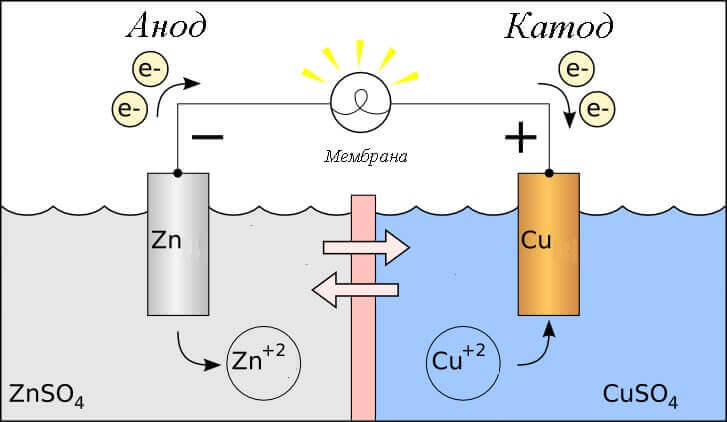
Vurder redoksreaksjonen i en galvanisk celle, hvilke prosesser skjer på elektrodene?
- anode - elektroden som er observert oksidativ reaksjondet vil si hangir elektroner. Elektroden som oksidasjonsreaksjonen skjer på kalles reduksjonsmiddel.
- katoden - elektroden som strømmer på utvinningsreaksjondet vil si hanaksepterer elektron. Elektroden som reduksjonsreaksjonen skjer på kalles oksidasjonsmiddel.
Dette stiller spørsmålet - hvor er plusset, og hvor er minus på batteriet? Basert på definisjonen av en galvanisk celle anode gir elektroner.
Viktig! GOST 15596-82 gir en offisiell definisjon av navnene på konklusjonene fra kjemiske strømkilder, kort sagt så pluss på katoden, og minus på anoden.
I dette tilfellet vurderes strømmen av elektrisk strøm. langs lederen av den eksterne kretsen fra oksydasjonsmiddel (katode) til Reduksjon (Anode). Siden elektronene i kretsløpet flyter fra minus til pluss, og elektrisk strøm er omvendt, så er katoden et pluss, og anoden er et minus.
Advarsel: strøm strømmer alltid inn i anoden!
Eller det samme i diagrammet:
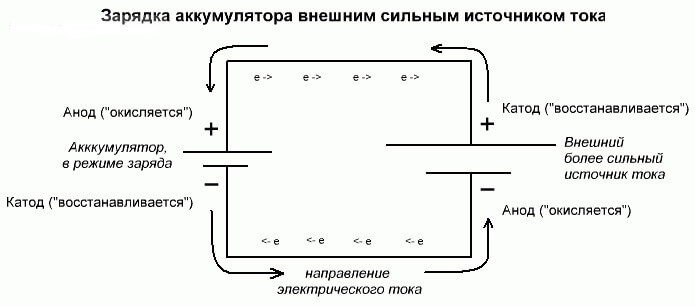
Batterielektrolyse eller ladeprosess
Disse prosessene er like og inverse til den galvaniske cellen, siden her ikke energi kommer fra en kjemisk reaksjon, men snarere - en kjemisk reaksjon oppstår på grunn av en ekstern strømkilde.
I dette tilfellet, pluss strømkilden kalles også katoden, og minus anoden. Men kontaktene til den ladbare galvaniske cellen eller elektrodene til elektrolysatoren vil allerede ha motsatte navn, la oss se hvorfor!
Viktig! Når en galvanisk celle blir utladet, er anoden negativ, katoden er pluss, og omvendt når den lades.
Siden strømmen fra den positive terminalen til strømkilden tilføres den positive terminalen til batteriet, kan sistnevnte ikke lenger være katoden.Under henvisning til det foregående, kan vi konkludere med at elektroder i batteriet i dette tilfellet betinget av bytter plass når det lades.
Så, gjennom elektroden til en ladet galvanisk celle som en elektrisk strøm strømmer inn i, kalles den en anode. Det viser seg at når du lader batteriet, blir plusset til anoden, og minus katoden.
galvanisering
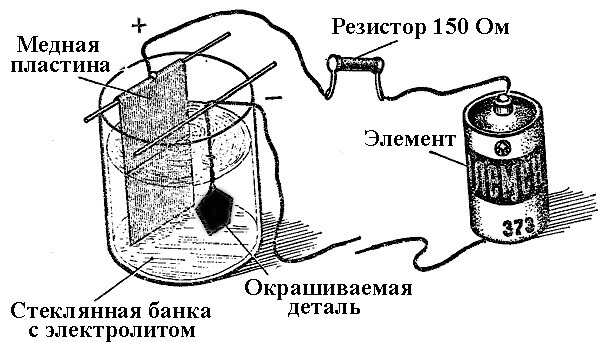
Prosessene med metallavsetning som et resultat av en kjemisk reaksjon under påvirkning av en elektrisk strøm (under elektrolyse) kalles galvanisk prosjektering. Dermed fikk verden forsølvet, forgylt, forkrommet eller andre metallbelagte smykker og detaljer. Denne prosessen brukes både til dekorative og til anvendte formål - for å forbedre korrosjonsmotstanden til forskjellige komponenter og mekanismer.
Prinsippet for drift av elektropletteringsanlegg ligger i bruk av saltløsninger av elementene som skal dekke delen som en elektrolytt.
Ved elektroplettering er anoden også en elektrode som den positive utgangen til kraftkilden er koblet til, henholdsvis er katoden i dette tilfellet et minus. I dette tilfellet blir metallet avsatt (redusert) på den negative elektroden (reduksjonsreaksjon). Det vil si, hvis du vil lage en forgylt ring med egne hender - koble den negative effekten fra strømforsyningen til den og legg den i en beholder med riktig løsning.
I elektronikk
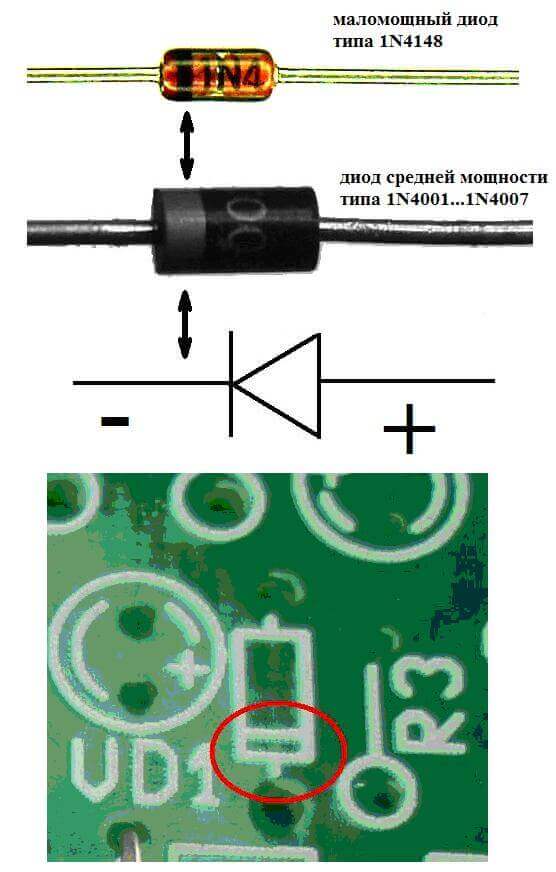
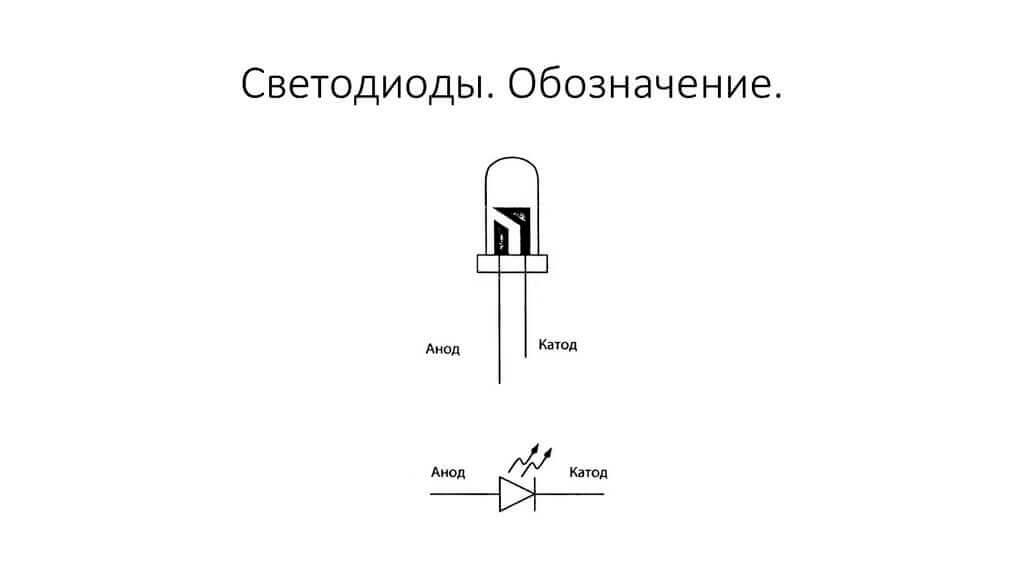
Elektrodene eller benene til halvledere og vakuumelektroniske apparater kalles også ofte anoden og katoden. Tenk på den betingede grafiske betegnelsen på en halvlederdiode i diagrammet:
Som vi ser, er anodene til dioden koblet til plusset til batteriet. Det kalles så av samme grunn - i dette tilfellet strømmer strømmen inn i diodens utgang i alle fall. På et ekte element på katoden er det en markering i form av en stripe eller en prikk.
Lysdioden er lik. På 5 mm lysdioder er innsidene synlige gjennom kolben. Halvparten som er større er katoden.
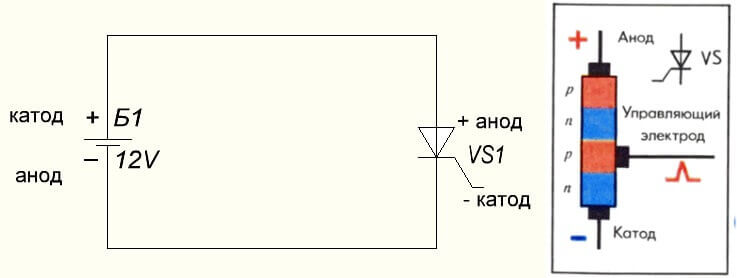
Situasjonen er også med tyristoren, formålet med konklusjonene og den "unipolare" anvendelsen av disse trebente komponentene gjør det til en kontrollert diode:
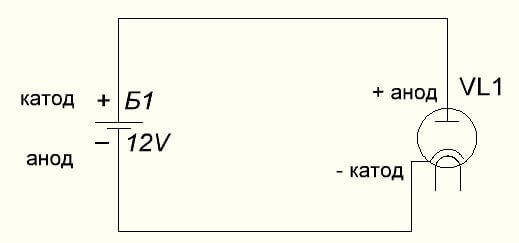
Vakuumdioden kobler også anoden til pluss, og katoden til minus, som er vist i diagrammet nedenfor. Selv om du bruker omvendt spenning, vil ikke navnene på disse elementene endre seg, til tross for strømmen av elektrisk strøm i motsatt retning, om enn ubetydelig.
Med passive elementer som kondensatorer og motstander er dette ikke tilfelle. Katoden og anoden er ikke isolert atskilt fra motstanden, strøm i den kan strømme i hvilken som helst retning. Du kan gi et hvilket som helst navn til konklusjonene, avhengig av situasjonen og ordningen det gjelder. Konvensjonelle ikke-polare kondensatorer. Mindre ofte observeres denne separasjonen av kontaktnavn i elektrolytiske kondensatorer.
konklusjon
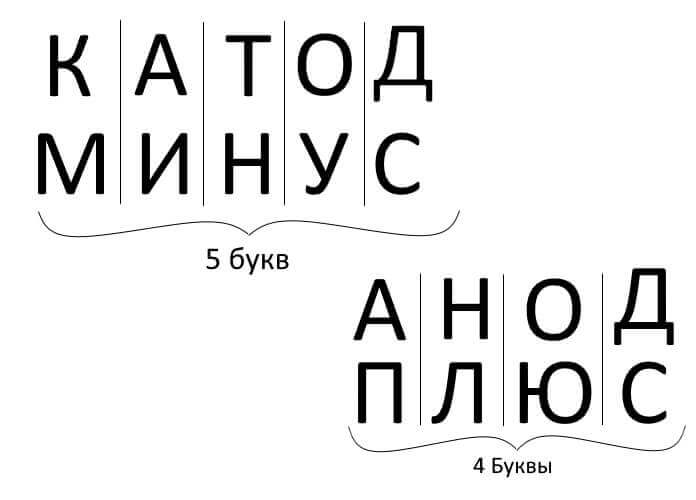
Så for å oppsummere, svare på spørsmålet: hvordan huske hvor er plusset, hvor er katoden minus med anoden? Det er en praktisk mnemonisk regel for elektrolyse, batterilading, elektroplettering og halvlederenheter. Disse ordene med lignende navn har samme antall bokstaver, som illustrert nedenfor:
I alle disse tilfellene strømmer strømmen fra katoden og strømmer inn i anoden.
Ikke bli forvirret av forvirringen: "hvorfor er katoden positiv for batteriet, og når det er ladet, blir det negativt?" Husk for alle elementer av elektronikk, så vel som elektrolysatorer og i elektroplettering - generelt, for alle energiforbrukere, er anoden output koblet til pluss. Forskjellene slutter der, nå er det lettere for deg å finne ut hva som er pluss og minus mellom utgangene til elementene og enhetene.
Til slutt anbefaler vi å se en nyttig video om artikkelen:
Nå vet du hva anoden og katoden er, samt hvordan du husker dem raskt nok. Vi håper informasjonen som ble gitt var nyttig og interessant for deg!
Relaterte materialer: