Hvad er anoden og katoden - en enkel forklaring
Elektrokemi og galvanisering
Der er to hovedafsnit inden for elektrokemi:
- Galvaniske celler - produktion af elektricitet gennem en kemisk reaktion. Disse elementer inkluderer batterier og akkumulatorer. De kaldes ofte kemiske strømkilder.
- Elektrolyse - virkningen på en kemisk reaktion med elektricitet, med enkle ord - ved hjælp af en strømkilde starter en reaktion.
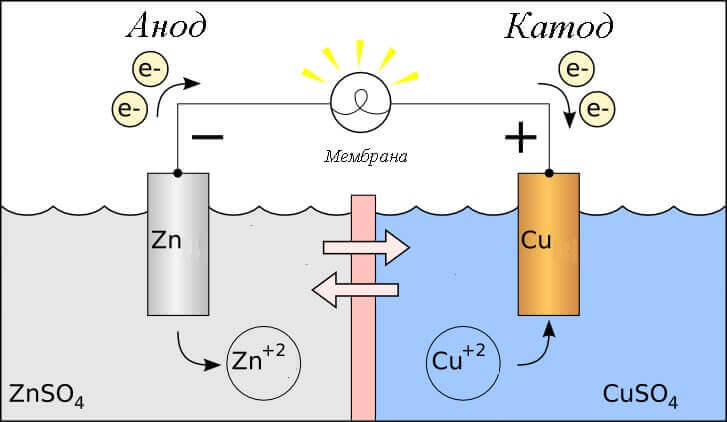
Overvej redox-reaktionen i en galvanisk celle, hvilke processer sker der på dens elektroder?
- Anode - den elektrode, der observeres oxidativ reaktiondet vil sige hangiver elektroner. Elektroden, hvorpå oxidationsreaktionen opstår, kaldes reduktionsmiddel.
- katode - den elektrode, der flyder på genvindingsreaktiondet vil sige hanaccepterer elektroner. Elektroden, hvorpå reduktionsreaktionen opstår, kaldes oxidationsmiddel.
Dette rejser spørgsmålet - hvor er plusset, og hvor er batteriets minus? Baseret på definitionen af en galvanisk celle anode giver elektroner.
Vigtig! GOST 15596-82 giver en officiel definition af navnene på konklusionerne fra kemiske strømkilder, kort sagt derefter plus på katoden og minus på anoden.
I dette tilfælde overvejes strømmen af elektrisk strøm. langs lederen af det eksterne kredsløb fra oxidationsmiddel (katode) til reduktionsmiddel (Anode). Da elektronerne i kredsløbet flyder fra minus til plus, og elektrisk strøm er omvendt, så er katoden et plus, og anoden er et minus.
Opmærksomhed: strøm flyder altid ind i anoden!
Eller det samme i diagrammet:
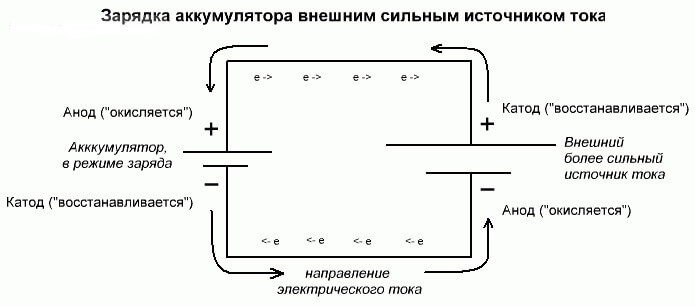
Batterielektrolyse eller opladningsproces
Disse processer ligner og er omvendt som den galvaniske celle, da her ikke energi kommer fra en kemisk reaktion, men snarere en kemisk reaktion sker fra en ekstern strømkilde.
I dette tilfælde kaldes strømforsyningen også katoden og minus anoden. Men kontaktene til den genopladelige galvaniske celle eller elektroder i elektrolysatoren har allerede modsatte navne, lad os se hvorfor!
Vigtig! Når en galvanisk celle udtømmes, er anoden minus, katoden er plus, og vice versa ved opladning.
Da strømmen fra den positive terminal i strømkilden tilføres den positive terminal på batteriet, kan sidstnævnte ikke længere være en katode.Under henvisning til det foregående kan vi konkludere, at i dette tilfælde elektroderne på batteriet betinget af skifter plads, når de oplades.
Derefter kaldes det gennem elektroden fra en ladet galvanisk celle, hvori en elektrisk strøm strømmer, en anode. Det viser sig, at når opladning af batteriet, bliver plus-en til anoden og minus katoden.
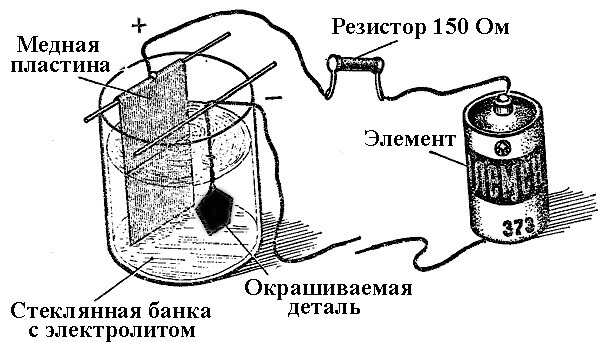
galvanisering
Processerne med metalaflejring som et resultat af en kemisk reaktion under påvirkning af en elektrisk strøm (under elektrolyse) kaldes galvanisk teknik. Således modtog verden sølvbelagte, forgyldte, forkromede eller andre metalbelagte smykker og detaljer. Denne proces anvendes både til dekorative og til anvendte formål - for at forbedre korrosionsbestandigheden af forskellige komponenter og samlinger af mekanismer.
Princippet om drift af elektropletteringsanlæg ligger i brugen af opløsninger af salte af de elementer, der dækker delen som en elektrolyt.
Ved elektroplettering er anoden også en elektrode, hvortil den positive udgang fra kraftkilden er forbundet, henholdsvis er katoden i dette tilfælde et minus. I dette tilfælde afsættes (reduceres) metallet på den negative elektrode (reduktionsreaktion). Det vil sige, hvis du ønsker at fremstille en forgyldt ring med dine egne hænder - tilslut den negative udgang fra strømforsyningen til den og anbring den i en beholder med den passende løsning.
I elektronik
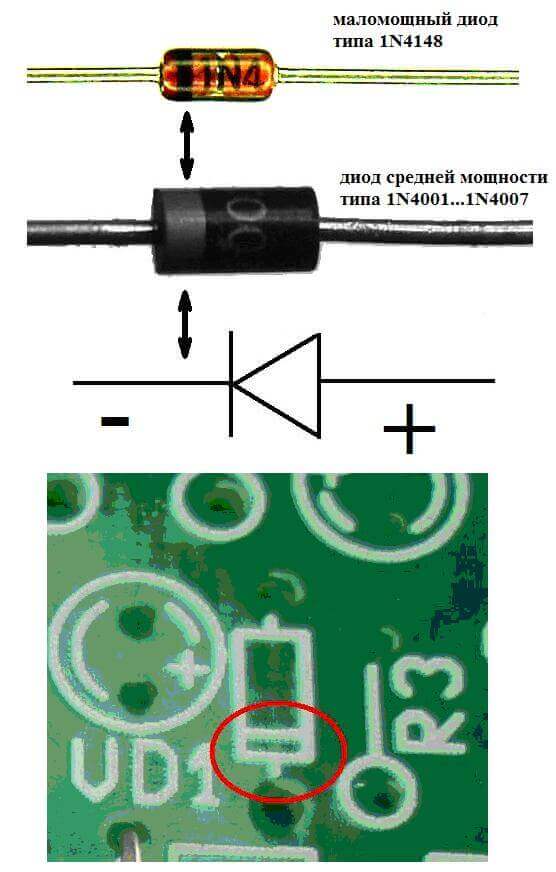
Elektroder eller ben af halvleder- og vakuumelektroniske enheder kaldes også ofte anoden og katoden. Overvej den betingede grafiske betegnelse for en halvlederdiode i diagrammet:
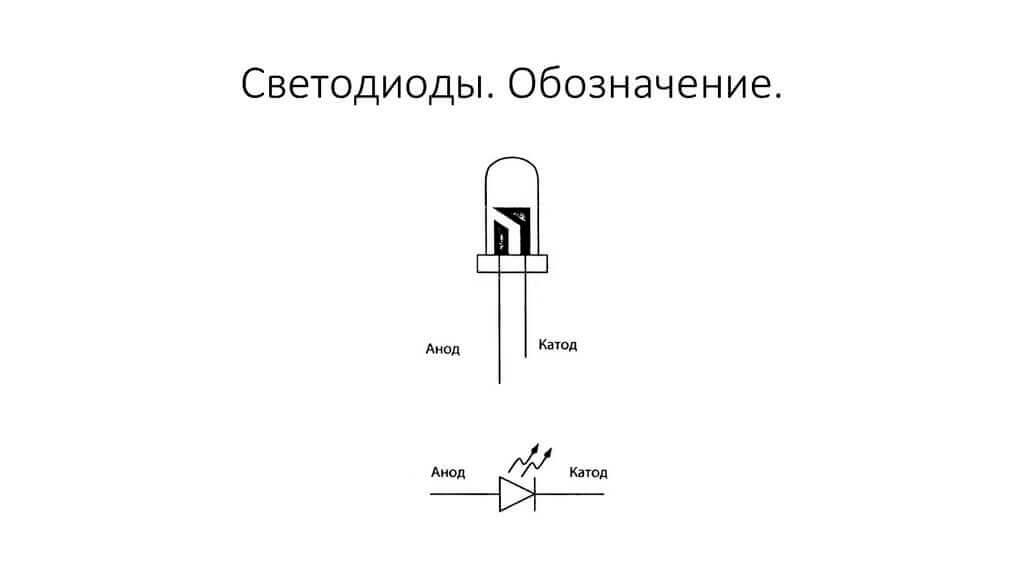
Som vi ser, er diodens anode tilsluttet batteriets plus. Det kaldes så af samme grund - i dette tilfælde strømmer strømmen ind i diodens output under alle omstændigheder. På et ægte element på katoden er der en markering i form af en strimmel eller en prik.
LED'en er ens. På 5 mm lysdioder er indersiden synlige gennem kolben. Den halvdel, der er større, er katoden.
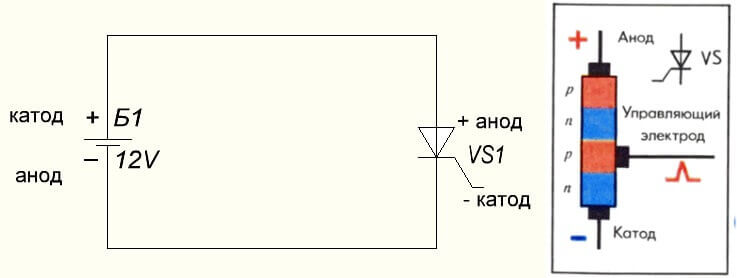
Situationen er også med tyristoren, formålet med konklusionerne og den "unipolære" anvendelse af disse trebenkomponenter gør det til en kontrolleret diode:
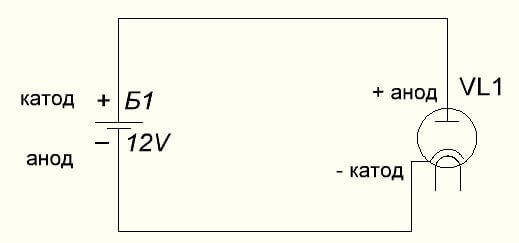
Vakuumdioden forbinder også anoden til plus og katoden til minus, som er vist i nedenstående diagram. Selvom man anvender omvendt spænding, ændres navnene på disse elementer ikke, på trods af strømmen af elektrisk strøm i den modsatte retning, omend ubetydelig.
Med passive elementer som kondensatorer og modstande er dette ikke tilfældet. Katoden og anoden isoleres ikke separat fra modstanden, strøm i den kan flyde i enhver retning. Du kan give ethvert navn til dens konklusioner, afhængigt af situationen og det aktuelle skema. Konventionelle ikke-polære kondensatorer også. Mindre almindeligt observeres denne adskillelse af kontaktnavne i elektrolytiske kondensatorer.
konklusion
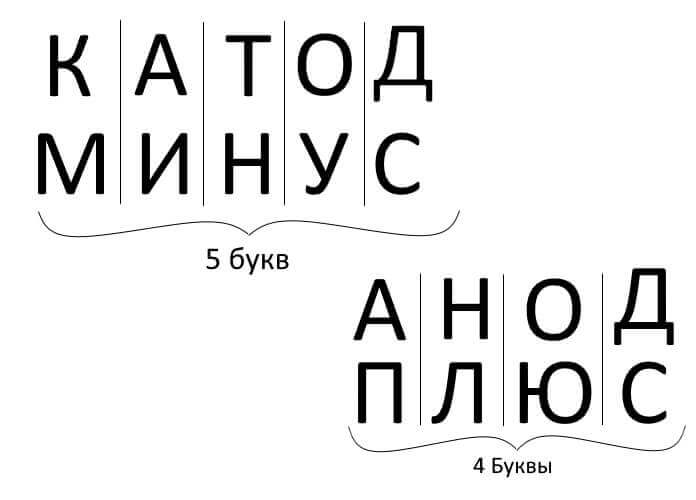
Så for at opsummere, besvare spørgsmålet: hvordan man kan huske, hvor er plusset, hvor er minus af katoden med anoden? Der er en praktisk mnemonisk regel til elektrolyse, batteriopladning, elektroplettering og halvlederenheder. Disse ord med lignende navne har det samme antal bogstaver, som illustreret nedenfor:
I alle disse tilfælde strømmer strømmen fra katoden og strømmer ind i anoden.
Bliv ikke forvirret af forvirringen: "hvorfor er katoden positiv for batteriet, og når det oplades, bliver det negativt?" Husk for alle elektronikelementer såvel som elektrolysatorer og elektroplettering - generelt for alle energiforbrugere er anoden output, der er tilsluttet plus. Forskellene slutter der, nu er det lettere for dig at finde ud af, hvad der er plus og minus mellem output og elementer og enheder.
Endelig anbefaler vi, at du ser en nyttig video om artiklets emne:
Nu ved du hvad anoden og katoden er, samt hvordan du husker dem hurtigt nok. Vi håber, at de givne oplysninger var nyttige og interessante for dig!
Relaterede materialer: