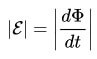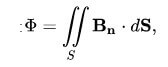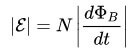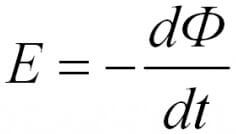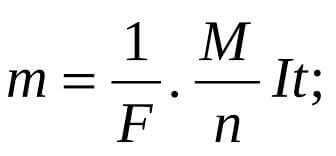Lleis de química i física de Faraday: una breu explicació en paraules simples
Història del descobriment
La llei de Faraday en electrodinàmica la va descobrir dos científics: Michael Faraday i Joseph Henry, però Faraday va publicar els resultats del seu treball abans del 1831.
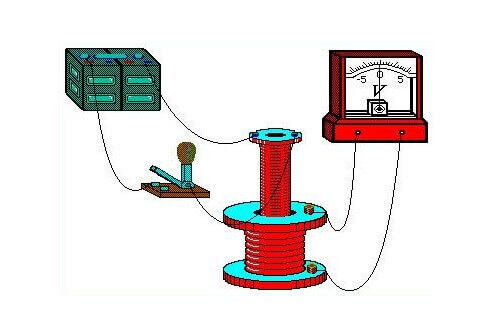
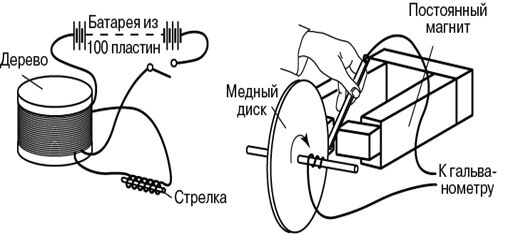
En els seus experiments demostratius a l’agost de 1831, va utilitzar un toro de ferro, als extrems oposats del qual es va enrotllar un filferro (un fil per costat). Va subministrar energia als extrems d’un primer filferro d’una bateria galvànica i va connectar un galvanòmetre als terminals del segon. El disseny era similar a un transformador modern. Engegar i desactivar periòdicament la tensió al primer filferro, va observar augmentades del galvanòmetre.
Un galvanòmetre és un instrument altament sensible per mesurar la força de petits corrents.
Així, es va representar la influència del camp magnètic generat pel flux de corrent del primer fil sobre l'estat del segon conductor. Aquest efecte es transmetia del primer al segon a través del nucli - un toro metàl·lic. Com a resultat de la investigació, també es va descobrir la influència d’un imant permanent, que es mou en la bobina, en el seu bobinat.
Després, Faraday va explicar el fenomen de la inducció electromagnètica en termes de línies de força. Un altre era la instal·lació per a generar corrent directe: un disc de coure girava a prop de l’imant i el filferro que es desplaçava al llarg d’aquest era un col·lector de corrent. Aquest invent es diu disc de Faraday.
Els científics d'aquest període no van reconèixer les idees de Faraday, però Maxwell va prendre la investigació per la base de la seva teoria magnètica. El 1836, Michael Faraday va establir relacions per a processos electroquímics, que es van anomenar les lleis d’electròlisi de Faraday. El primer descriu les relacions de la massa de la substància assignada a l’elèctrode i el corrent que flueix, i el segon descriu les proporcions de la massa de la substància a la solució i el corrent assignat a l’elèctrode per a una certa quantitat d’electricitat.
Electrodinàmica
Els primers treballs s’utilitzen en física, concretament en la descripció del funcionament de màquines i aparells elèctrics (transformadors, motors, etc.). La Llei de Faraday estableix:
Per al circuit, l’EMF induït és directament proporcional a la magnitud de la velocitat del flux magnètic, que es mou per aquest circuit amb un signe menys.
Es pot dir amb paraules simples: com més ràpid es mou el flux magnètic pel circuit, més emf es genera als seus terminals.
La fórmula és la següent:
Aquí dF és el flux magnètic, i dt és la unitat de temps. La primera vegada que la derivada és la velocitat.És a dir, la velocitat de moviment del flux magnètic en aquest cas concret. Per cert, pot moure's, com una font d'un camp magnètic (una bobina amb corrent - un electroimant o un imant permanent), i un circuit.
Aquí, el flux es pot expressar mitjançant la següent fórmula:
B és el camp magnètic i dS és la superfície.
Si considerem una bobina amb voltes ferides, mentre que en el nombre de voltes N, la llei de Faraday és la següent:
Flux magnètic en fórmula d'una sola revolució, mesurat a Weber. El corrent que circula al circuit s’anomena inducció.
La inducció electromagnètica és un fenomen de flux de corrent en un circuit tancat sota la influència d’un camp magnètic extern.
A les fórmules anteriors, podríeu observar els signes del mòdul, sense que tingués un aspecte lleugerament diferent, com es deia a la primera formulació, amb un signe menys.
El signe menys explica la regla de Lenz. El corrent que sorgeix en el circuit crea un camp magnètic, es dirigeix al contrari. Això és una conseqüència de la llei de conservació de l’energia.
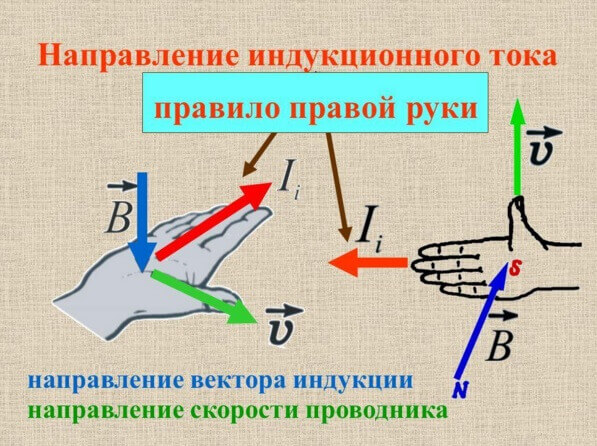
La direcció del corrent d’inducció es pot determinar mitjançant la regla de la mà dreta o gimlet, ho vam examinar detalladament al nostre lloc.
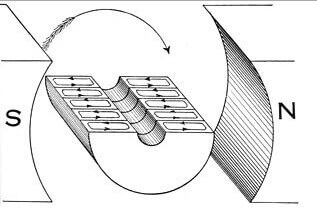
Com ja s’ha comentat, a causa del fenomen de la inducció electromagnètica, funcionen màquines elèctriques, transformadors, generadors i motors. La il·lustració mostra el flux de corrent en el bobinat de l'armadura sota la influència del camp magnètic de l'estator. En el cas del generador, quan el rotor gira per forces externes, un EMF apareix als enrotllaments del rotor, el corrent genera un camp magnètic dirigit en sentit contrari (el mateix signe menys en la fórmula). Com més gran sigui el corrent que consumeix la càrrega del generador, major serà el camp magnètic i més difícil serà la seva rotació.
I viceversa: quan el corrent flueix en el rotor, apareix un camp que interactua amb el camp estator i el rotor comença a girar. Amb una càrrega a l’eix, el corrent a l’estator i al rotor augmenta, i cal assegurar la commutació de les bobines, però aquest és un altre tema relacionat amb la construcció de màquines elèctriques.
Al cor del funcionament del transformador, la font del flux magnètic en moviment és un camp magnètic altern derivat del flux de corrent altern en el bobinat primari.
Si voleu estudiar el tema amb més detall, us recomanem veure un vídeo on es descriu fàcilment i fàcilment la Llei de Faraday per a la inducció electromagnètica:
Electròlisi
A més de la investigació sobre EMF i la inducció electromagnètica, el científic va fer grans descobriments en altres disciplines, inclosa la química.
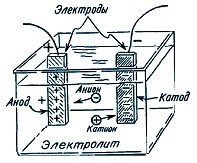
Quan el corrent flueix per l'electròlit, els ions (positius i negatius) comencen a precipitar-se cap als elèctrodes. Moviment negatiu a l’ànode, positiu per al càtode. Al mateix temps, una certa massa de la substància continguda en l'electròlit és alliberada en un dels elèctrodes.
Faraday va realitzar experiments, passant un corrent diferent a través de l'electròlit i mesurant la massa de matèria dipositada als elèctrodes, en va deduir els patrons.
m = k * Q
m és la massa de la substància, q és la càrrega i k depèn de la composició de l'electròlit.
Es pot expressar un càrrec en termes de corrent durant un període de temps:
I = q / taleshores q = i * t
Ara podeu determinar la massa de la substància que s’alliberarà, coneixent el corrent i el temps que va fluir. Es diu així la primera llei d’electròlisi de Faraday.
La segona llei:
La massa de l’element químic que s’instal·la sobre l’elèctrode és directament proporcional a la massa equivalent de l’element (massa molar dividida per un nombre que depèn de la reacció química en què es troba la substància).
Segons les anteriors, aquestes lleis es combinen amb la fórmula:
m és la massa de la substància alliberada en grams, n és el nombre d’electrons transferits en el procés d’elèctrodes, F = 986485 C / mol és el nombre de Faraday, t és el temps en segons, M és la massa molar de la substància g / mol.
En realitat, per diverses raons, la massa de la substància alliberada és inferior a la calculada (quan es calcula el flux actual). La relació de masses teòriques i reals s'anomena eficiència actual:
Bt = 100% * mcàlcul/ mte
Per acabar, us recomanem que mireu una explicació detallada de la llei de Faraday per l’electròlisi:
Les lleis de Faraday van contribuir significativament al desenvolupament de la ciència moderna, gràcies al seu treball comptem amb motors elèctrics i generadors d’energia elèctrica (així com el treball dels seus seguidors). El treball d’EMF i els fenòmens d’inducció electromagnètica ens va proporcionar la majoria dels equips elèctrics moderns, inclosos altaveus i micròfons, sense els quals és impossible escoltar enregistraments i comunicacions de veu. Els processos d’electròlisi s’utilitzen en el mètode galvànic de materials de recobriment, que aporta tant valor decoratiu com pràctic.
Materials similars: