Què és l’ànode i el càtode: una explicació senzilla
Electroquímica i galvanoplàstia
Hi ha dues seccions principals en electroquímica:
- Cèl·lules galvàniques: la producció d’electricitat mitjançant una reacció química. Aquests elements inclouen piles i acumuladors. Sovint s’anomenen fonts de corrent químic.
- Electròlisi: l'impacte d'una reacció química amb l'electricitat, en paraules simples, amb l'ajuda d'una font d'energia, s'inicia una reacció.
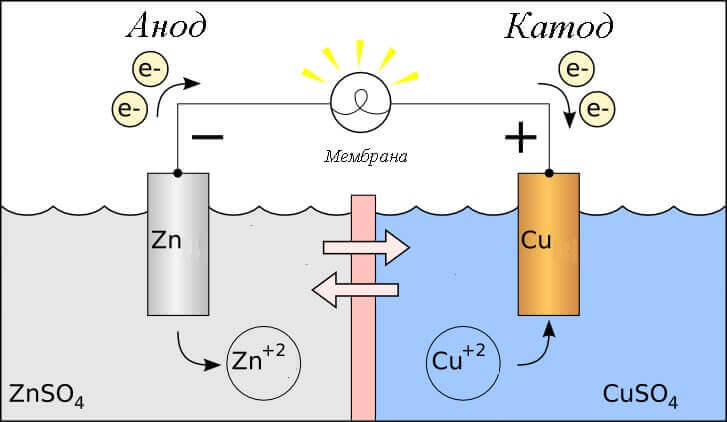
Considereu la reacció redox en una cèl·lula galvànica, i quins processos es produeixen en els seus elèctrodes?
- Ànode - l'elèctrode on s'observa reacció oxidativaés a dir, elldóna electrons. S'anomena l'elèctrode on es produeix la reacció d'oxidació agent reductor.
- Càtode - l'elèctrode sobre el qual flueix reacció de recuperacióés a dir, ellaccepta electrons. S'anomena l'elèctrode on es produeix la reacció de reducció agent oxidant.
Això fa la pregunta: on és el plus i on és el menys de la bateria? Basat en la definició d’una cèl·lula galvànica l’ànode dóna electrons.
Important! GOST 15596-82 dóna una definició oficial dels noms de les conclusions de les fonts de corrents químiques, en definitiva, més un sobre el càtode i menys sobre l’ànode.
En aquest cas, es considera el flux de corrent elèctric. al llarg del conductor del circuit extern des de oxidant (càtode) a reductant (ànode). Com que els electrons del circuit flueixen de menys a plus, i el corrent elèctric és viceversa, el càtode és un avantatge i l’ànode és un menys.
Atenció: el corrent sempre flueix a l’ànode!
O el mateix al diagrama:
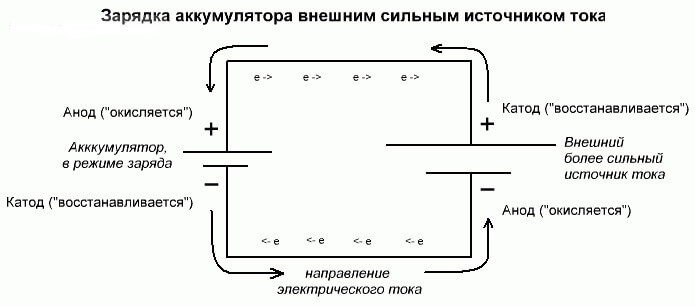
Procés d’electròlisi o càrrega de la bateria
Aquests processos són similars i inversos a la cèl·lula galvànica, ja que aquí no l’energia prové d’una reacció química, sinó que es produeix una reacció química provinent d’una font d’electricitat externa.
En aquest cas, més la font d’energia també s’anomena càtode, i menys l’ànode. Però els contactes de la cèl·lula galvànica recarregable o dels elèctrodes de l'electròlisi ja tindran noms oposats, vegem per què!
Important! Quan es descarrega una cèl·lula galvànica, l’ànode és menor, el càtode és més i viceversa quan es carrega.
Com que el corrent del terminal positiu de la font d’energia es subministra al terminal positiu de la bateria, aquest últim ja no pot ser un càtode.En referència a l’anterior, podem concloure que en aquest cas els elèctrodes de la bateria canvien condicionalment de lloc quan es carrega.
A continuació, a través de l’elèctrode d’una cèl·lula galvànica carregada a la qual flueix un corrent elèctric, s’anomena ànode. Resulta que en carregar la bateria, el plus es converteix en l’ànode i menys el càtode.
Galvanoplàstia
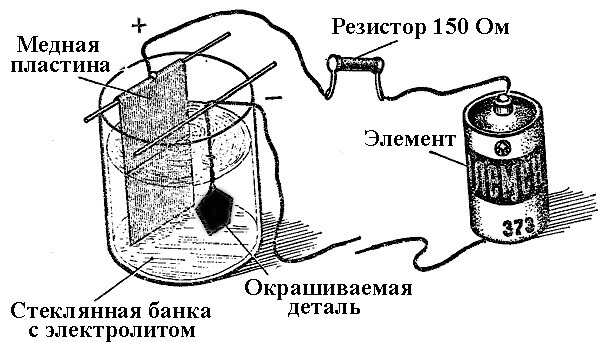
Els processos de deposició de metalls com a resultat d’una reacció química sota la influència d’un corrent elèctric (durant l’electròlisi) s’anomenen enginyeria galvànica. Així, el món va rebre joies i detalls de plata, daurat, cromat o d’altres. Aquest procés s’utilitza tant per a fins decoratius com per a aplicacions, per millorar la resistència a la corrosió de diversos components i conjunts de mecanismes.
El principi de funcionament de les plantes de galvanització està en l’ús de solucions salades dels elements que recorreran la part com a electròlit.
En electroplating, l’ànode també és un elèctrode al qual es connecta la sortida positiva de la font d’energia, respectivament, el càtode en aquest cas és menys. En aquest cas, el metall es diposita (reduït) a l’elèctrode negatiu (reacció de reducció). És a dir, si voleu fer un anell daurat amb les vostres pròpies mans, connecteu-hi la sortida negativa de la font d’energia i poseu-la en un recipient amb la solució adequada.
En electrònica
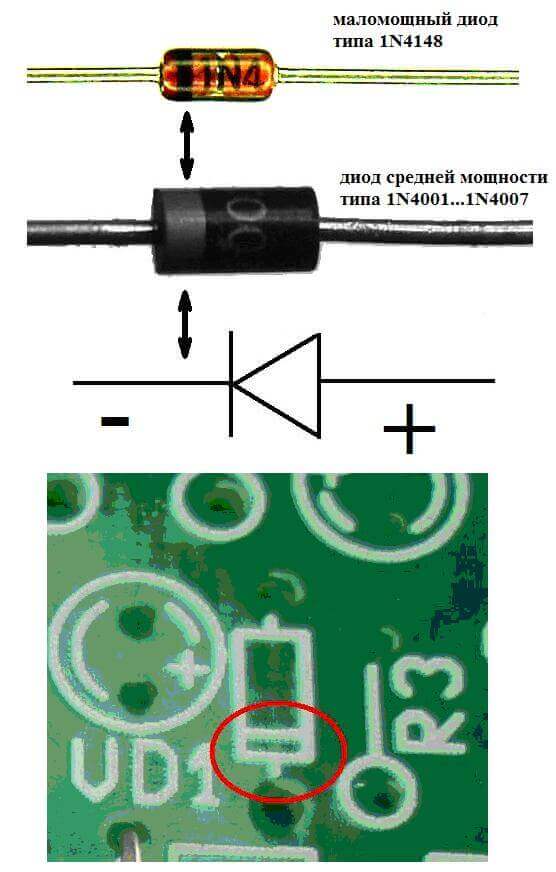
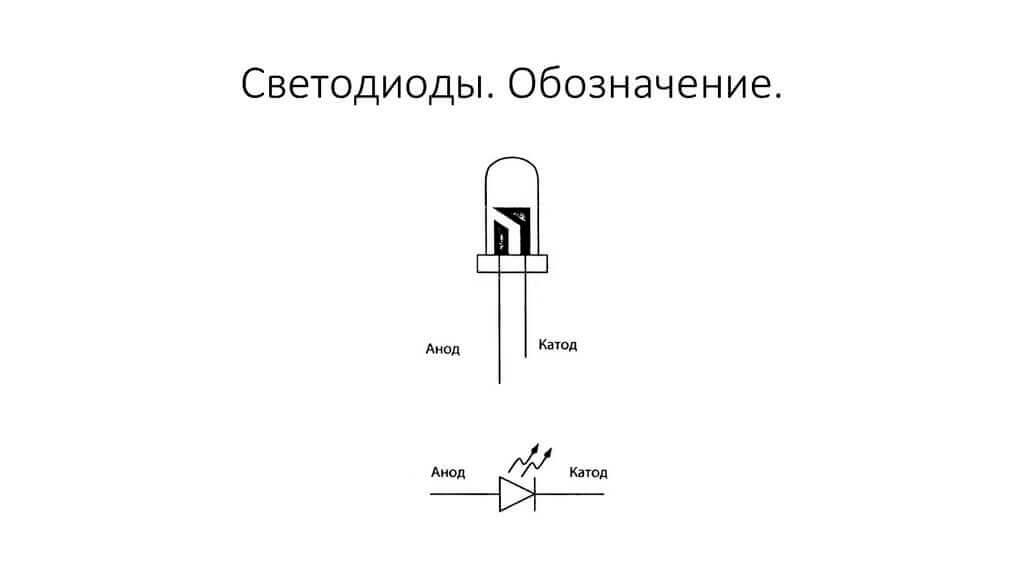
Els elèctrodes o potes dels dispositius electrònics de semiconductor i buit també s’anomenen sovint ànode i càtode. Considereu la designació gràfica condicional d'un díode semiconductor en el diagrama:
Com veiem, l’ànode del díode està connectat al plus de la bateria. Es diu així per la mateixa raó: en aquest cas, el corrent flueix a la sortida del díode en qualsevol cas. En un element real del càtode hi ha un marcatge en forma de ratlla o punt.
El LED és similar. Amb LED de 5 mm, els accessoris són visibles a la matràs. La meitat que és més gran és el càtode.
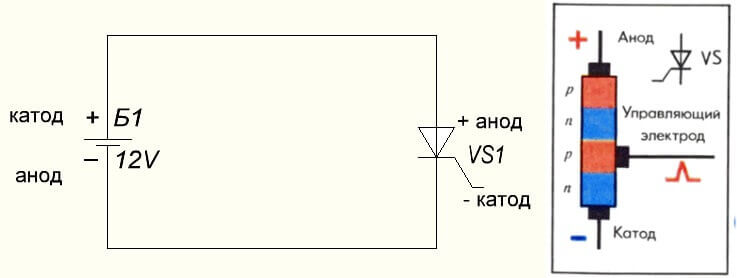
La situació passa també amb el tiristor, l'objectiu de les conclusions i l'aplicació "unipolar" d'aquests components de tres potes el converteixen en un díode controlat:
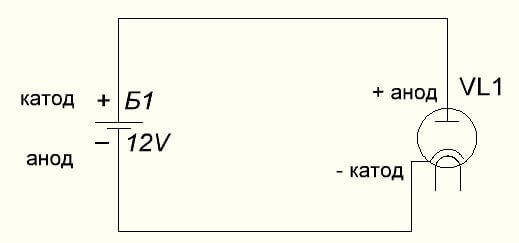
El díode al buit també connecta l’ànode al plus, i el càtode al minus, que es mostra al diagrama següent. Tot i que quan s’aplica tensió inversa, els noms d’aquests elements no canviaran, malgrat el flux de corrent elèctric en el sentit contrari, tot i que insignificant.
No és així amb elements passius com condensadors i resistències. El càtode i l’ànode no estan aïllats per separat de la resistència; el corrent que pot fluir en qualsevol direcció. Podeu posar qualsevol nom a les seves conclusions, segons la situació i l’esquema de què es tracti. Condensadors no polars convencionals també. Menys freqüentment, aquesta separació de noms de contacte s’observa en condensadors electrolítics.
Conclusió
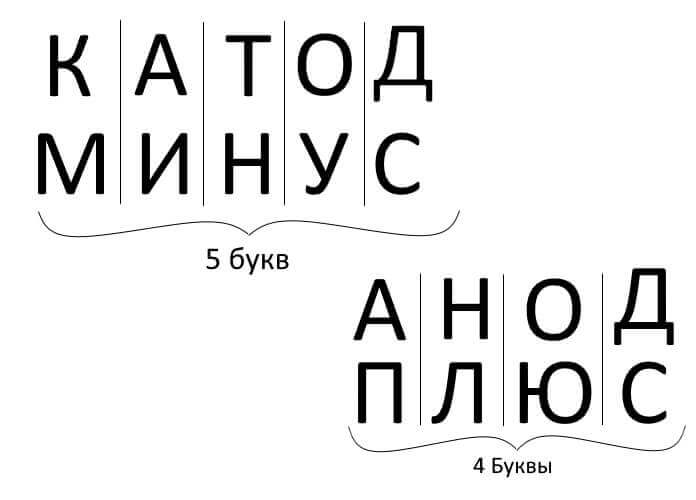
Per tant, per resumir, responent a la pregunta: com recordar on és el plus, on és el minus del càtode amb l’ànode? Hi ha una regla mnemònica convenient per a l'electròlisi, la càrrega de la bateria, la galvanització i els dispositius semiconductors. Aquestes paraules amb noms semblants tenen el mateix nombre de lletres, com es mostra a continuació:
En tots aquests casos, el corrent flueix des del càtode i flueix a l’ànode.
No us confongueu per la confusió: "per què és positiu el càtode per a la bateria i quan es carrega es converteix en negatiu?" Recordeu-vos de tots els elements de l'electrònica, així com dels electrolitzadors i en la galvanització: en general, per a tots els consumidors d'energia, l'ànode és la sortida connectada al plus. Les diferències s’acaben, ara us serà més fàcil esbrinar quins són els avantatges i els menys entre les sortides dels elements i dispositius.
Per acabar, recomanem veure un vídeo útil sobre el tema de l’article:
Ara ja saps quins són l’ànode i el càtode, així com com es poden memoritzar prou ràpidament. Esperem que la informació facilitada sigui útil i interessant per a vosaltres!
Materials relacionats: